脑科学与脑医学学院徐贞仲团队CellReports发文揭示少突胶质细胞调控帕金森病发展的分子机制
来源:浙江大学 时间:2025-03-24 22:55:38
帕金森病(Parkinson’s disease, PD)是一种常见的神经退行性疾病,由中脑黑质区(Substantia nigra pars compacta,SNpc)多巴胺能(dopaminergic,DA)神经元变性引起,导致静止性震颤、运动迟缓等运动障碍1和非运动功能障碍(例如约30-85%的PD患者伴有慢性疼痛的发生2)。我国60岁以上人群中PD的患病率约为1.06%,且近年来呈显著增长趋势3。然而,由于发病机制尚不明确,PD治疗面临挑战。近年研究表明少突胶质细胞与PD进展存在显著关联4, 5,但其调控PD发生发展的具体机制仍不清楚。
近日,浙江大学医学院脑科学与脑医学学院、双脑中心徐贞仲课题组在《Cell Reports》上发表了题为“Oligodendrocytes drive neuroinflammation and neurodegeneration in Parkinson’s disease via the prosaposin-GPR37-IL-6 axis”的研究论文,揭示了少突胶质细胞通过prosaposin-GPR37-IL-6信号轴驱动神经炎症和神经退行性病变,进而调控PD发生发展的分子细胞机制。

本研究发现G蛋白偶联受体37(GPR37)选择性表达于中脑的少突胶质细胞,且在PD模型小鼠黑质中显著上调。通过多种PD模型验证,成年小鼠少突胶质细胞条件性敲除Gpr37可有效缓解多巴胺能神经元丢失、运动功能障碍以及慢性疼痛。进一步研究发现,GPR37内源性配体prosaposin (PSAP)富集于多巴胺能神经元,且在模型小鼠脑脊液中分泌显著增加。机制研究表明,PSAP类似物通过GPR37依赖的信号通路触发少突胶质细胞分泌IL-6,从而加剧神经炎症并导致多巴胺能神经元退变。最后,研究验证了人类多巴胺能神经元表达PSAP,且PD患者脑脊液中PSAP和IL-6水平显著升高。综上所述,本研究发现多巴胺能神经元可能通过分泌PSAP与少突胶质细胞互作,并揭示了少突胶质细胞作为免疫调节性胶质细胞在PD进程中驱动神经炎症和神经元丢失的新机制。本研究阐明了PSAP -GPR37-IL-6信号轴作为PD发病的关键驱动因素(图1),为缓解PD患者疾病进展提供了潜在治疗靶。
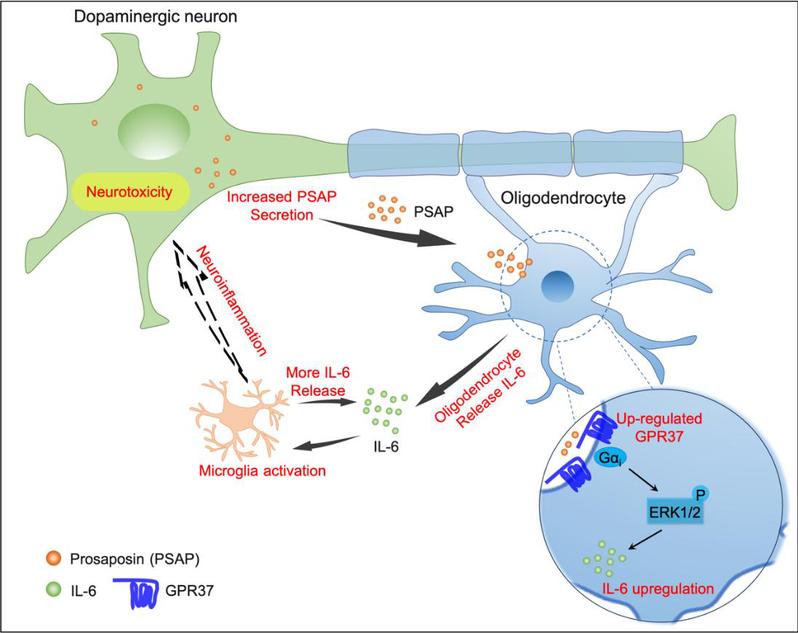
图1. 少突胶质细胞通过PSAP-GPR37-IL-6信号轴驱动PD中神经炎症和神经退行性病变
浙江大学脑科学与脑医学学院博士后马强为本研究第一作者及共同通讯作者,博士生田进兰以及楼瑶为共同第一作者,浙江大学脑科学与脑医学学院、医学院附属第一医院徐贞仲教授为最后通讯作者。该研究工作得到了浙江大学医学院段树民院士、章京教授、赵经纬教授,浙江省人民医院郭然博士、李顺主任,杭州师范大学邱猛生教授,以及国家健康和疾病人脑组织资源库的大力支持。该研究主要受国家自然科学基金、科技创新2030-“脑科学与类脑研究”重大项目、浙江省自然科学基金、以及教育部双脑中心等资助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00037-3







