生命科学学院易文/朱强团队揭示糖基化调控肿瘤代谢和免疫逃逸的新机制
来源:浙江大学 时间:2025-01-28 00:56:46
代谢重编程是肿瘤的基本特征之一。肿瘤细胞即使在氧气充足的条件下仍优先通过糖酵解途径产生能量,这种现象被称为Warburg效应。研究表明结直肠癌是一种具有典型Warburg 效应的肿瘤,在其发生发展过程中,有氧糖酵解起着非常重要的作用,抑制Warburg 效应显著抑制了结直肠癌细胞增殖以及肿瘤生长。因此,靶向有氧糖酵解选择性杀灭肿瘤细胞的治疗策略成为抗肿瘤药物研发的重要方向。
逃避免疫系统监视的能力也是肿瘤的重要特征之一。程序性死亡配体1(PD-L1)是一种在癌细胞表面高度表达的关键免疫检查点蛋白。PD-L1能与细胞毒性T淋巴细胞表面的PD-1相结合,从而抑制T细胞的抗肿瘤活性。最近,以PD-1/PD-L1抑制剂为典型代表的免疫检查点阻断疗法已成为治疗多种肿瘤的有效策略。然而,PD-1/PD-L1抑制剂治疗晚期结直肠癌的疗效并不理想,仅部分亚型的结直肠癌患者从中获益。PD-L1蛋白表达水平被认为是评估抗PD-L1/PD-1治疗的临床反应性的关键生物标志物。因此,深入探究PD-L1的表达调控机制以及开发新的联合治疗药物靶点对于结直肠癌的免疫治疗至关重要。
乙酰葡萄糖胺修饰(O-GlcNAcylation)是近年来发现的一种发生在细胞内蛋白丝氨酸或者苏氨酸残基上的单糖修饰,其失调与肿瘤等人类疾病的发生发展密切相关。研究表明O-GlcNAc糖基化修饰在结直肠癌等多种肿瘤中显著上调,然而其促进肿瘤发生发展的机制有待进一步的研究。
2024年10月25日,浙江大学生命科学学院易文/朱强团队在PNAS杂志上在线发表了题为 “O-GlcNAcylation of enolase 1 serves as a dual regulator of aerobic glycolysis and immune evasion in colorectal cancer”的研究论文。该研究揭示了O-GlcNAc 糖基化通过调控烯醇化酶(enolase 1, ENO1)来影响结直肠癌糖代谢以及免疫逃逸的机制,为结直肠癌的治疗提供可能的新靶点。

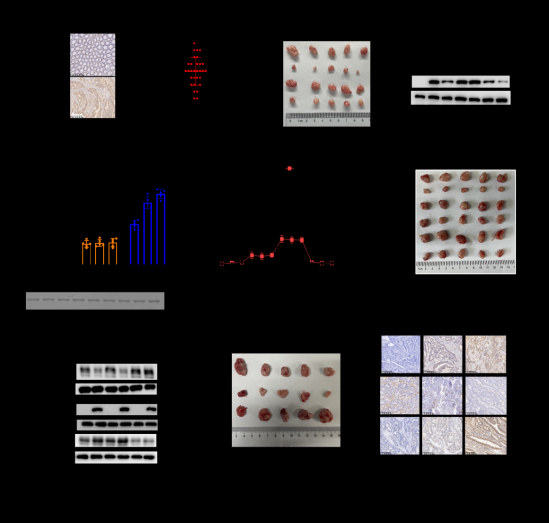
研究团队首先通过免疫组化分析发现与癌旁组织相比,ENO1的表达水平在结肠癌组织中显著上调(图1A)。细胞增殖以及裸鼠成瘤实验证实了ENO1促进肿瘤生长主要依赖于ENO1的代谢酶功能(图1B)。研究人员接下来通过化学酶联标记的方法证实了ENO1蛋白具有高度的O-GlcNAc糖基化修饰,同时通过质谱检测结合点突变的生化手段,确定了苏氨酸19位(T19)以及丝氨酸249位(S249)是ENO1上主要的糖基化修饰位点(图1C)。运用体外酶活实验以及细胞生物学实验,研究人员验证了T19的糖基化增强了 ENO1的酶活,激活了结直肠癌细胞的Warburg 效应,促进肿瘤生长(图1D-1F)。同时,研究团队发现S249的糖基化抑制了ENO1与PD-L1的互作,并阻断了泛素连接酶STUB1介导的PD-L1泛素化以及蛋白酶体降解,促进了 PD-L1蛋白表达,进而激活 PD-1/ PD-L1 介导的肿瘤免疫逃逸(图1G-1H)。此外,抑制ENO1两个位点的糖基化能联合PD-L1单抗协同抑制结直肠肿瘤生长。临床样本分析发现ENO1的糖基化水平在结直肠癌样品中显著升高,与PD-L1的表达呈显著正相关,与CD8+ T细胞的浸润水平呈显著负相关(图1I), 提示ENO1的糖基化在结直肠癌临床免疫治疗和检测中具有重要的意义。
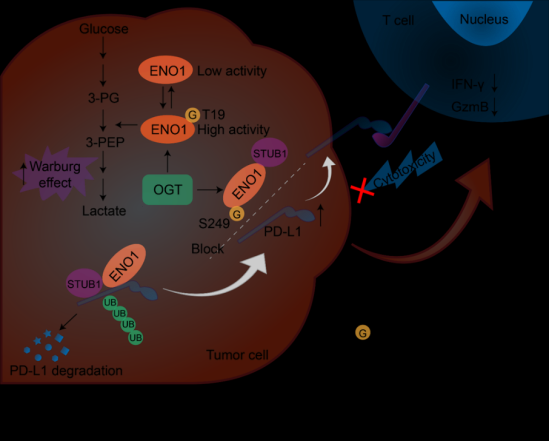
总之,该研究揭示了ENO1的O-GlcNAc 糖基化调控结直肠癌代谢重编程以及免疫逃逸的新机制(图2),强调干预ENO1糖基化可以作为结肠癌临床治疗的潜在策略。
浙江大学生命科学学院百人计划研究员朱强为论文的第一作者。朱强和易文教授为论文的共同通讯作者。浙江大学生命科学学院王勇研究员参与了这项工作。这项工作得到了国家杰出青年基金、面上和青年基金,以及浙江大学创新团队建设经费的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2408354121







