龚为民/孙金鹏团队合作揭示整个组胺受体家族的配体识别及激活的分子机制
来源:中国科学技术大学 时间:2025-02-14 06:38:26
组胺是一种广泛分布的生物胺,是中枢神经系统中的神经递质,也是免疫系统、肠道和皮肤中的重要信号分子。组胺在人体中广泛存在,由肥大细胞、肠嗜铬样细胞和神经元等细胞分泌,参与一系列重要生理过程的调节,包括过敏反应、胃酸分泌、觉醒和炎症反应等。许多组胺功能由 G 蛋白偶联组胺受体介导,其中包括四个成员,H1R、H2R、H3R 和 H4R。
事实上,长期以来人们一直认为组胺释放引起的炎症反应是由组胺 H1 受体介导的,而 H1 受体拮抗剂(通常称为抗组胺药)多年来一直用于治疗过敏。常用的组胺H1受体拮抗剂,如苯海拉明、异丙嗪、氯苯那敏等,是目前应用最广泛的非特异性抗过敏药物。此外,H2受体拮抗剂,如西咪替丁、尼扎替丁、雷尼替丁等,被广泛用于抑制胃酸过度分泌,治疗十二指肠溃疡、胃溃疡、胃食管反流、胃灼热等消化性溃疡病。此外,H3R拮抗剂匹特里赞特(Waxx®)已获批用于治疗发作性睡病和阻塞性睡眠呼吸暂停(Ozawade®)。组胺受体激动剂的药物开发进展则相对滞后。H1R的激动剂在理论上有可能调节神经系统的认知、觉醒等功能,但在外周组织中有促炎作用,目前定位的困难使其难以作为相关疾病的药物进行开发。H2R的激动剂则被研究发现有可能用于急性髓性白血病的治疗。H3R集中分布于神经系统,其激动剂不会在外周组织中引起副作用,因此很有潜力作为相关神经系统疾病如强迫性障碍的药物。H4R的激动剂也具有促炎作用,但用于疾病治疗的可能性有待于进一步研究。
2024年9月27日,中国科学技术大学龚为民课题组与山东大学孙金鹏课题组合作在Nature Communications杂志在线发表了题为Structural basis of ligand recognition andactivation of the histamine receptor family的研究论文,系统报道了在内源性组胺或其他合成配体存在下,四种组胺家族受体亚型与四种不同的下游 G 蛋白复合的九种低温电子显微镜 (cryo-EM) 结构。该研究为理解所有四种组胺受体的配体识别和 G 蛋白偶联提供了一个结构框架,这可能有助于合理设计针对这些受体的配体。

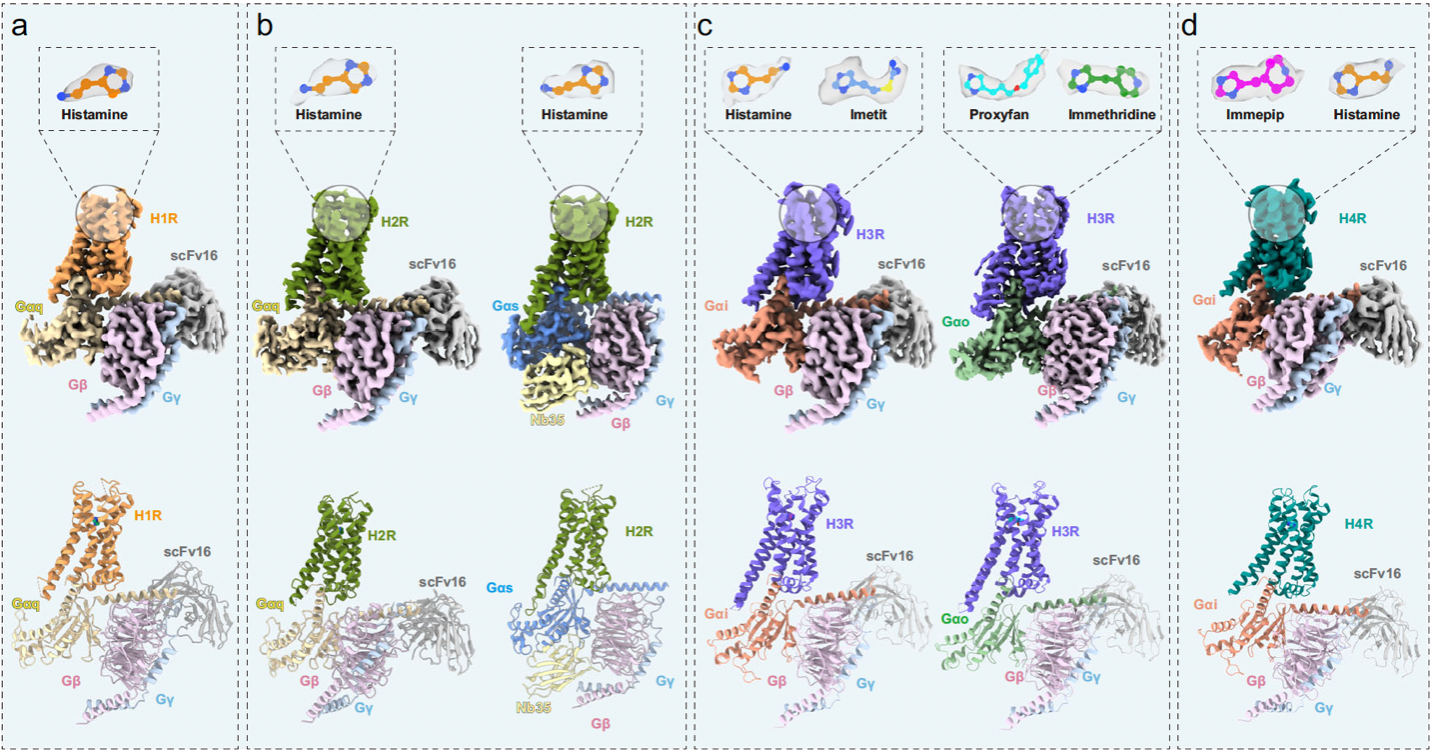
图 组胺受体与相应 G 蛋白复合体的整体结构
研究人员发现在组胺结合的H1R-Gq、H2R-Gs/q、H3R-Gi和H4R-Gi复合物中,酸性残基D3.32在组胺识别中起着关键作用,正如许多G蛋白偶联受体(GPCRs)在识别生物胺类分子时一样。同时,所有组胺受体的两个疏水残基Y/V3.33和Y6.51与组胺相互作用。D3.32-Y/V3.33-Y6.51基序在所有组胺受体中共享,表明该基序在组胺识别中起着关键作用。有趣的是,组胺在H3R和H4R的配体口袋中的结合方向与在H1R和H2R中的观察结果相反,这源于咪唑环旋转了约180°。进一步的结构和序列比较以及突变研究发现,H1R和H2R的TM6中保守的F6.52X2F6.55和H3R与H4R的TM7中的F7.39X3W7.43是决定这些不同结合方向的关键因素。结构比较显示,H1R和H2R的配体结合口袋与H3R和H4R的明显不同。H1R和H2R中存在两个特定口袋(正构口袋和次级结合口袋),而H3R和H4R中则存在三个特定口袋(正构口袋、次级结合口袋以及跨膜亚口袋)。这些口袋中的残基差异可以用于设计特异性靶向组胺受体成员的配体。此外,结构和药理学分析表明,immethridine(H3R选择性配体)刚性吡啶环与 H3R 中 L4017.42的特异性相互作用是其对 H3R 而非 H4R 选择性的关键决定因素。H3R 中的 L4017.42与 H4R 中的 Q3477.42之间的序列差异也可以用于设计专门靶向 H3R 或 H4R 的配体。
此外,研究人员发现在H2R胞质侧的ICL3是Gs/Gq耦合差异的决定因素。一个有趣的后续问题是,不同的组胺受体成员如何选择性地与Gs或Gi/Go蛋白耦合。研究人员通过更深入的结构和药理学分析发现,H2R的TM5与Gs更紧密的结合方式,以及H3R和H4R的R34.54-F/V6.25-R6.29基序与Gi/Go的独特相互作用,是不同组胺受体成员之间Gs和Gi/o选择性的基础。此项研究不仅可以进一步加深我们对整个组胺受体家族配体识别、激活及G蛋白耦合机制的理解,还可能有助于设计选择性靶向组胺受体家族成员的配体。
中国科学技术大学龚为民教授、山东大学孙金鹏教授、肖鹏教授和中国科学技术大学特任副研究员张旋(现University of Pittsburgh博士后)为该论文的共同通讯作者,中国科学技术大学张旋博士、刘桂兵博士、山东大学博士生钟亚妮、张茹,山东大学硕士生杨传承为本论文共同第一作者。此外,本研究中冷冻电镜数据在中国科学技术大学冷冻电镜中心收集,冷冻电镜中心高永翔博士也为该工作作出了重要贡献。
原文链接:https://www.nature.com/articles/s41467-024-52585-y
(合肥微尺度物质科学国家研究中心、科研部)







