生科院饶玉春教授团队在农学顶级期刊TheCropJournal发表研究成果
来源:浙江师范大学 时间:2025-02-19 23:45:44
水稻作为人类的重要粮食作物之一,类病斑、稻瘟病和水稻条纹病毒等病害的发生对水稻的品质和产量造成不可逆的影响,我国粮食安全受到严重威胁。研究表明,水稻类病斑突变体在受到各种病原菌的侵染后抗性都有所增强。因此,水稻类病斑突变体可进一步解析植物抗病防御反应和细胞程序性死亡相关途径的分子调控机制,是用来研究水稻先天性免疫反应和细胞死亡机制的理想型材料。
近日,浙江师范大学生命科学学院饶玉春团队在农学顶级期刊The Crop Journal(SCI一区top,IF=6.6)在线发表题为“LMI1, a DUF292 protein family gene, regulates immune responses and cell death in rice”的研究论文。作者以水稻类病斑突变体lmi1为研究对象,基于生物化学、分子生物学、生理学和细胞生物学分析,发现LMI1基因编码DUF292蛋白,会影响水稻对白叶枯的抗病能力,并通过叶绿体中的囊泡运输调节防御免疫反应和细胞死亡。

本研究从粳稻云稻32的EMS突变体库中筛选到一个具有类病斑表型的水稻突变体lmi1,突变体分蘖初期开始,叶片上出现点状病斑表型且随着水稻的生长发育变大且增多,在分蘖盛期时病斑最多,类病斑的出现一直持续到成熟期;该病斑受光诱导调控。图位克隆结果显示LMI1编码DUF292蛋白家族,N端(氨基端)含有一个Ist1家族的Pfam结构域。LMI1的单碱基突变导致水稻在出现类病斑表型的同时,对水稻白叶枯病菌的抗性明显增强,与防御相关基因OsAOS2、OsBIMK2、OsMPK12、OsNPR2、OsPR1b、OsWRKY53及LYP6的表达均显著升高。酵母双杂和BiFC实验证明LMI1会与磷酸酶及ESCRT-III组分因子蛋白互作结合共同调控水稻先天性免疫反应和细胞死亡,并且互作会改变LMI1的定位。该研究为进一步解析PCD及植物抗病防御免疫反应相关途径的调控机制奠定基础。本研究挖掘到一个新的调控水稻先天性免疫反应和细胞死亡的基因LMI1,利用生化、分子等技术开展生理生化实验,揭示其可能的作用机理,对深入了解水稻DUF292蛋白家族基因参与先天性免疫反应和细胞死亡调控分子机制具有重要意义。从分子生物学和细胞生物学水平,进一步揭示其类病斑基因的分子调控机制,同时也为水稻育种方面及培育水稻高抗品种新资源的创制提供新的理论基础和研究策略。

Fig. 1 – Phenotypic characterization of wild-type and lmi1 mutant. (A) Phenotype of wild-type and lmi1 mutant at tillering stage, scale bar, 10 cm. (B) Leaf phenotype at wild-type and lmi1 mutant at tillering stage, scale bar, 2 cm. (C) Phenotype of lmi1 mutant before and after 7 d of shading treatment, scale bar, 1 cm.

Fig. 2 – Chloroplast development and photosynthetic efficiency in wild-type and lmi1 mutant. (A–C) Scanning electron microscopic observation of wild-type with fold changes of 200 ×, 500 ×, 3000 ×, scale bar, 200 μm, 100 μm, 10 μm. (D–F) Scanning electron microscopic observation of lmi1 with fold changes of 200 ×, 500 ×, 3000 ×, scale bar, 200 μm, 100 μm, 10 μm. (G) SPAD values. (H) Chlorophyll content. (I) Photosynthetic efficiency. (J–K) Chloroplast ultrastructure of wild-type. Scale bar, 20 μm, 1 μm. (L–M) Chloroplast ultrastructure of lmi1. Scale bar, 20 μm, 1 μm. (N) Chlorophyll synthesis related genes expression. (O) Chloroplast development related gene expression. *, P < 0.05; **, P < 0.01 (t-test). C, chloroplast; Thy, thylakoid; Og, osmophilic gramules; Sg, starch granule; N, nucleus.

Fig. 3 – Physiological and biochemical analysis of wild-type and lmi1 mutant. (A) DAB staining. Scale bar, 1 cm. (B) NBT staining Scale bar, 1 cm. (C) H2O2 content. (D) POD activity. (E) SOD activity. (F) MDA content. (G) PRO content. (H–I) TUNEL plots of wild-type. Scale bar, 100 μm. (J–K) TUNEL plots of lmi1. Scale bar, 100 μm. *, P < 0.05; **, P < 0.01 (t-test).
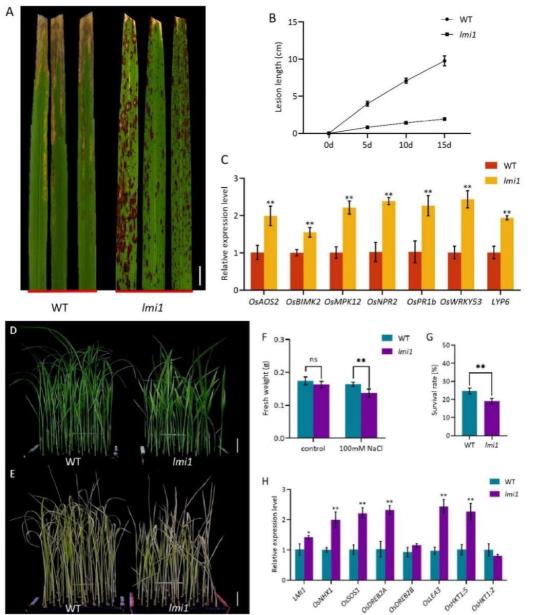
Fig. 4 – LMI1 regulates defense responses in rice. (A) Phenotypes of wild-type and lmi1 were observed 15 d after inoculation, scale bar, 1 cm. (B) Statistical results of bacterial blight spot length on 0, 5, 10 and 15 d after inoculation. (C) Defense related genes expression. *, P < 0.05; **, P < 0.01 (t-test).
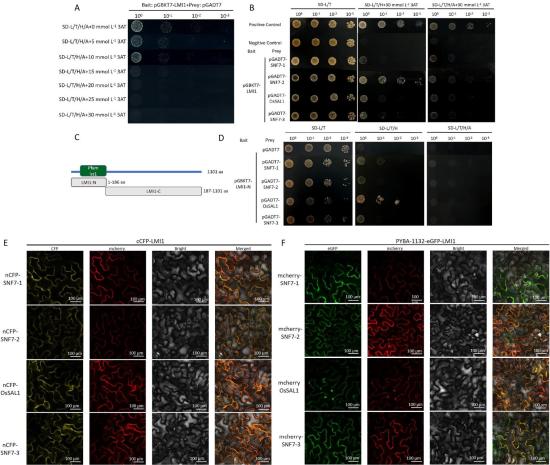
Fig. 5 – LMI1 interacts with phosphatase and components of ESCRT-III complex. (A) Validation and inhibition of LMI1 yeast bait autoactivation. (B) The yeast two-hybrid interaction analysis of LMI1 with 30 mmol L-1 3AT. (C) Schematic representation of the Pfam domain truncation of the LMI1 protein. (D) LMI1-N truncated yeast two-hybrid interaction verification analysis. (E) Verification of LMI1 BiFC, scale bar, 100 μm. (F) Gene co-localization verification of LMI1. Scale bar, 100 μm. Note: SD-L/T represented two-deficient solid medium lacking leucine (Leu) and tryptophan (Trp). SD-L/T/H represents triple deficient solid medium lacking leucine (Leu), tryptophan (Trp) and histidine (His). SD-L/T/H/A represents a four-deficient solid medium lacking leucine (Leu), tryptophan (Trp), histidine (His) and adenine (Ade).
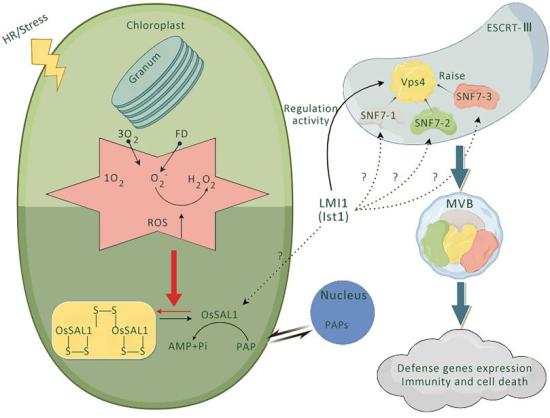
Fig. 6 – Possible pathways by which LMI1 regulates disease resistance immune responses and cell death.
本研究成果第一作者为浙江师范大学生命科学学院硕士研究生殷文晶(已毕业,目前在华中农业大学作物遗传改良全国重点实验室、湖北洪山实验室攻读博士学位),浙江师范大学饶玉春教授、中国水稻研究所王跃星研究员和安庆师范大学穆丹教授为共同通讯作者。浙江师范大学生命科学学院硕士研究生钟芊芊、杨茜以及本科生朱哲楠、张芷宁、顾育嘉等参与本项研究。
近年来,团队和合作者在水稻叶片形态特征发育机制和穗部器官演化方面取得了关键进展,先后挖掘了调控水稻叶绿体发育的基因WLP3(SCI一区top,Rice,2023,16: 59),通过生理生化实验揭示其可能的作用机理,进一步阐明水稻核糖体蛋白参与叶绿体发育调控的分子机理,该研究有助于培育具有高光合效率的优质高产水稻新品种;控制水稻早衰基因ESL1(SCI一区top,The Crop Journal,2022,10: 310-322),该研究通过生理生化及遗传学研究手段揭示了黄嘌呤脱氢酶调控水稻生长和叶片衰老的分子机制,ESL1通过维持ROS的稳态来调控光合作用和叶绿体发育及降解途径,研究结果有助于构建和完善水稻叶片早衰分子调控网络,对水稻产量和品质育种具有重要的理论和指导意义;高温致病斑基因HES1(SCI一区top,New phytologist,2022,233(1): 344-359)报道了UDP-N-乙酰氨基葡萄糖焦磷酸化酶在水稻对高温胁迫的适应中起关键作用,HES1功能缺失导致ROS爆发和叶绿体降解,引发DNA损伤和细胞凋亡,促进了其体内ROS的积累;水稻类病斑基因SPL36(SCI一区top,Rice,2021,14: 34),首次明确了类受体激酶在水稻叶片病斑发生过程的作用机制,也是首次报道了类受体激酶参与水稻耐胁迫和抗病相关进程;控制水稻小穗基因LRG1(SCI一区top,Science Bulletin,2020,65(9): 753-764),该研究进一步证实了副护颖、护颖和外稃是同源器官,为护颖恢复成外稃提供了可能,为“三花小穗”假说提供了支持;多花小穗基因MOF1(SCI一区top,Plant Physiology,2020,184(1): 251-265)深度解析了水稻小穗内小花数目的调控机制,提供了一条新的增加“每穗粒数”的方法和观点,为培育“多花小穗”水稻品种提高每穗粒数,进而提高水稻产量奠定基础。
本研究得到浙江省自然科学基金重点项目(LZ23C130003)、中国农业科学院创新工程(CAAS-CSCB-202402)和国家重点研发计划基金(2021YFA1300703)的赞助和支持。
编辑:张文潇







