药学院陈侠斌教授团队在ProceedingsoftheNationalAcademyofSciences(PNAS)上发文为激酶融合蛋白抗肿瘤药物的开发提供了新的设计思路
来源:杭州师范大学 时间:2025-01-24 15:07:07
近日,我校药学院陈侠斌教授团队在国际顶级期刊Proceedings of the National Academy of Sciences(PNAS,美国科学院院刊,IF = 11.1)上发表题为“CCDC6- RET fusion protein regulates Ras/MAPK signaling through the fusion-GRB2-SHC1 signal niche”的研究论文,为激酶融合蛋白抗肿瘤药物的开发提供了新的设计思路。

酪氨酸激酶RET(Rearranged during transfection)的异常激活,是多种癌症发生发展的关键因素。其中,基因重排导致的融合蛋白产生,是RET致癌转换的主要机制之一。融合蛋白的形成改变了RET原有的亚细胞定位,增加了蛋白表达水平,形成了以非配体依赖的方式激活下游信号通路,导致细胞的异常增殖和癌变。CCDC6-RET融合蛋白是第一个被发现的RET融合蛋白,在乳头状甲状腺癌、非小细胞肺癌等多种癌症中高频率出现,是重要的肿瘤治疗靶点。且相比于其他RET融合蛋白,CCDC6-RET呈现出对于经典RET抑制剂不一样的反应,提示其在肿瘤发展中特殊的作用机制。因此,深入探讨CCDC6-RET融合蛋白驱动肿瘤发生的作用机制对于扩大RET融合蛋白致癌机制的了解以及开发针对RET融合阳性肿瘤的靶向疗法具有重要意义。
陈侠斌教授团队针对CCDC6-RET的促癌机制,以蛋白质液-液相分离(Liquid liquid phase separation, LLPS)为切入点,提出了一种新的作用模式。近年来,无膜生物凝聚体作为激酶调控信号通路的新机制受到广泛关注。该团队深入探究了CCDC6-RET融合蛋白LLPS的发生机制,CCDC6-RET 的LLPS不仅依赖于具有激酶活性的RET激酶域,也依赖于作为partner的CCDC6部分,两者共同维系了LLPS与激酶活性的相互依赖关系。研究发现,CCDC6-RET融合蛋白加强了与GRB2的相互作用力,并通过LLPS招募接头蛋白GRB2和效应蛋白SHC1,形成了一个无膜的信号聚集颗粒——RET fusion-GRB2-SHC1 signal niche,通过signal niche促进Ras/MAPK信号通路的传导(图1)。

图1 RET fusion- GRB2- SHC1形成 signal niche模型示意图
于此同时,研究人员还发现RET抑制剂的加入会破坏signal niche的形成,Ras/MAPK的信号通路也随之被抑制。通过免疫共沉淀实验发现,signal niche的三种组分间的相互作用也被破坏(图2)。由于RET融合蛋白的产生改变了RET蛋白原有的细胞定位,其构象可能也随之改变,导致传统RET抑制剂对其的抑制效果不佳。同时融合partner的无序序列,为设计靶向融合蛋白的抑制剂带来了挑战。陈侠斌教授团队的这一发现,为激酶融合蛋白抗肿瘤药物的开发提供了新的设计思路:即通过破坏signal niche的形成,而非直接针对融合蛋白自身的激酶活性,就能达到抑制激酶信号的效果,从而抑制RET融合阳性肿瘤增殖。
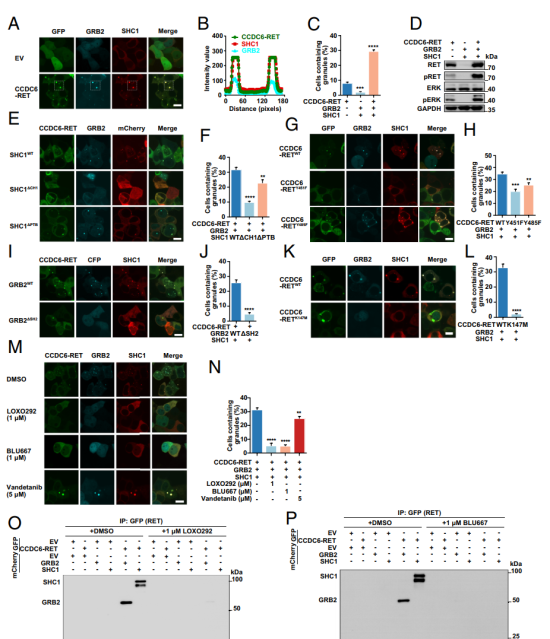
图2 RET fusion- GRB2- SHC1形成signal niche调控Ras/MAPK信号传导
在该论文成果中,我校药学院邱婷副教授、博士研究生孔熠超、魏桂凤为共同第一作者,陈侠斌教授、谢恬教授、邱婷副教授为共同通讯作者。该论文成果的完成过程中得到了西湖大学杨培国教授的大力支持。杭州师范大学为第一完成单位。该论文成果接受国家自然科学基金、浙江省自然科学基金项目资金资助。







