【科研速递】材化学院刘俊秋教授团队在AdvancedMaterials上发表分子马达驱动的光控逻辑门钾离子通道研究成果
来源:杭州师范大学 时间:2025-03-07 11:19:26
近日,我校材料与化学化工学院刘俊秋教授团队在光控逻辑门离子通道领域取得新进展,相关研究成果以题为Molecular Motor-Driven Light-Controlled Logic-Gated K+ Channel for Cancer Cell Apoptosis发表于国际知名期刊Advanced Materials(IF=29.4)上。

众所周知,天然通道蛋白(NCPs)可实现相关物种在细胞膜上的高选择性传输,并具有优异、独特的门控性质,其动态调控特性体现在传输状态的多态性,以及对不同环境变化的适应性。通过向自然界学习,人工仿生离子通道的研究有助于揭示NCPs更深层次的动态机制,并进一步为通道相关疾病的早期诊断和治疗提供新思路。目前,科学家所构建的具有动态行为的人工跨膜离子转运系统是基于对NCPs的有限认识而设计的,这些人工离子转运系统仅仅关注于简单的"ON/OFF"状态转换。因此,开发出能够处理复杂信息并实现分步离子转运调节的新型跨膜转运系统十分具有挑战性。
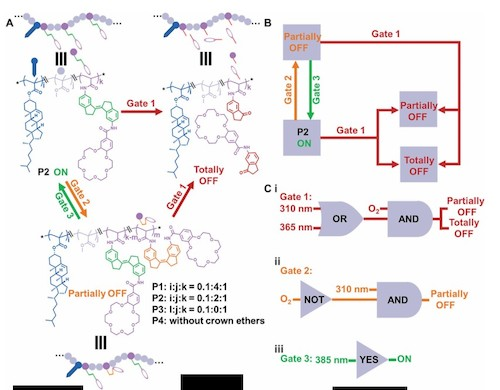
针对以上问题,刘俊秋教授团队联合西北工业大学闫毅教授团队首次提出光控逻辑门离子通道的概念,并将该人工钾通道用于抗癌治疗。作者将分子马达概念与人工离子通道概念结合起来,构建了一种基于分子马达的单链无规共聚合物(RHPs)的光控逻辑门控K+通道,该通道具有类似多核处理器的特性,可逐步控制离子传输。以氧气、脱氧和不同波长的光作为输入信号进行设计,建立了由 "YES"、"AND"、"OR "和 "NOT "门元件组成的复杂逻辑电路。执行这些逻辑电路用K+的传输状态作为输出信号,研究人员在脂质体和癌细胞中均实现了多种传输状态的转换,包括 "开启"、"部分关闭 "和 "完全关闭",从而进一步实现了分步抗癌治疗。在 "ON "状态下,急剧的K+外流(7 分钟内减少 50%)可显著诱导癌细胞凋亡。这种集成的逻辑门控通道不仅有助于人们理解NCPs的微妙机制,并且在癌症或其他疾病治疗领域同样具备潜在应用价值。
光控逻辑门通道的制备和表征过程如下:首先,利用RAFT聚合制备了P1, P2和P3三种聚合物,用HPTS囊泡实验发现P2的传输活性最好,具有最高的传输活性和K+/Na+选择性。为了确定碱金属离子为主要的传输种类,采用了光泽精囊泡实验证明P2几乎不传氯离子。高的K+/Na+选择性通常能够产生膜电位,用藏红T实验确定了其膜电位的产生。研究人员利用脂双层研究了P2的传输机理,从脂双层实验结果看出,明显的电流信号表明P2是以通道的机制传输钾离子,而不是以转运体的机制,采用反转电位测定了其K+/Na+选择性高达9.63。
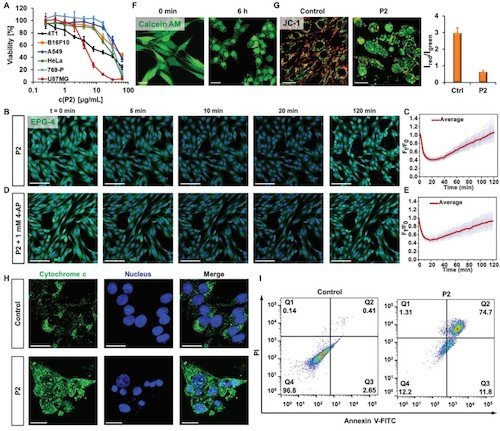
由于单体M1在具备光敏性E-Z互变的化学性质,因此,该分子马达在不同的逻辑门指令下,可以发生可逆转变或者不可逆的光氧化断裂。通过紫外光谱表征发现,对(E)-M1执行“Gate 1”指令时,结构上会发生光氧化断裂(340 nm和360 nm处的特征吸收峰消失),对(E)-M1执行“Gate 2”指令时,结构上会部分变成(Z)-M1;再执行“Gate 3”,又会变成(E)-M1。通过对P2执行不同的逻辑门指令,可以发生结构上的转变。对于其功能上的转变,用钾离子的传输速率作为输出信号,从HPTS实验发现,执行“Gate 1”指令时,K+的传输活性可以从“开”切换到“完全关闭”的状态。执行“Gate 2”指令时,K+的传输活性可以从“开”变成“部分关闭”的状态,再次执行“Gate 3”指令时,可以从“部分关闭”切换到“开”的状态。测定P2 的抗癌效果发现P2对U87-MG等6种细胞均具有优良的抗癌活性,并且该抗癌效果与K+的外流密切相关。通过细胞色素C的释放,线粒体膜电位的丢失以及流式实验证明癌细胞是以凋亡的机制死亡的。在细胞层面验证该逻辑门指令的可行性发现通过对P2执行不同的逻辑门指令,K+外流的速率不同,并且可以控制癌细胞的凋亡。
该论文首次提出逻辑门控仿生离子通道的概念,对于理解天然通道的门控行为机制具有重要的生物学意义,也为开发在生物学和医药学领域具有潜在应用的智能仿生纳米通道提供了全新的思路。
该论文第一作者为李聪博士生(杭州师范大学与西北工业大学联合培养),我校材化学院刘俊秋教授、祝鼎成副教授、闫腾飞副教授和西北工业大学闫毅教授为共同通讯作者,杭州师范大学为第一完成单位。该论文成果接受国家自然科学基金,科技部重点研发计划等项目资金资助。







